
1.研究の背景
1)プロスタグランジン(PG)とは
プロスタグランジン(Prostaglandin、PG)は、炭素数20個からなるエイコサノイドの1つであり、プロスタン酸骨格を有し様々な生理活性を発現する物質群を指す。PGは精液中に存在する子宮を収縮させる作用を持つ物質として、1935年にスウェーデンの生理学者 Ulf von Eulerとイギリス/アイルランドの生理学者Maurice Walter Goldblattによって、それぞれに発見された。当時、PGは前立腺 (Prostate:プロステート) から分泌されると考えられていたためPGと命名されたが、後に精嚢腺で合成されることが判明した。単離されたPGは微量で構造決定が難しかったが、1962年にスウェーデンの生化学者 Sune Bergströmらは数トンにも及ぶ羊の精嚢腺からPGを精製しその構造を決定した。その後、1969年にE. J. Coreyらにより天然に存在する(-)-PGE2の完全合成が報告された。この業績に対して1989年に日本賞が贈られている。Merk Indexによれば、PGE2は最も一般的で生理活性の強いPGであると記載されており、1977年にアメリカ食品医薬品局に登録され、分娩誘発、分娩後出血の予防や新生児の動脈管開存のために用いられるようになった。一方、1971年にアスピリン様薬がPG合成を阻害することが発見され、Sune Bergström、イギリスの薬理学者John R. Vain及びスウェーデンの生化学者Bengt I. Samuelssonの3名は1982年にノーベル生理医学賞を受賞した()。

The Nobel Prize (https://www.nobelprize.org/prizes/medicine/1982/vane/facts/)
2)PGの生合成とその機能
PGの合成はほぼすべての有核細胞において行われ、ヒトや動物のほとんどの組織に存在する。PGは決まった組織や細胞から作られるホルモンとは異なり、局所で生合成され速やかに分解するためオータコイド(局所ホルモン)に分類されている。PGは生体膜の成分であるジアシルグリセロールからホスホリパーゼA2から切り出されるアラキドン酸を出発原料として合成される(Fig.1)。遊離したアラキドン酸はシクロオキシゲナーゼ (COX1/2) によりPGG2へ変換され、さらに同じ酵素が持つペルオキシダーゼ活性によりPGH2へと代謝される。さらに、細胞毎に発現が異なるPG合成酵素により、特徴的な生理活性を有するPGへと代謝され生理活性を発揮する。シクロオキシゲナーゼを介して産生される生理活性物質には、プロスタサイクリン(PGI2)、PGD2、PGE2、PGF2α及びトロンボキサン(TAX2)があり、これらのエイコサノイドはプロスタノイドとよばれている。一方、白血球やマクロファージではリポキシゲナーゼ(LOX)を介した代謝経路が活性化されロイコトリエンが合成される。

Fig. 1 PGの合成経路 PGD2、PGE2、PGF2a、PGI2(プロスタサイクリン) 及びTXA2の5化合物がPGH2から直接合成され、プロスタノイドとよばれる。PGF2aはPGE2からPGE2 9 keto reductaseを介しても合成される
生体膜に存在する炭素数20個からなる不飽和脂肪酸は、アラキドン酸に加えジホモγリノレン酸、エイコサペンタエン酸が存在し、これらの脂肪酸から合成される生理活性もPGに分類される。PGは分子内に存在する不飽和結合の数により分類される。すなわち、アラキドン酸から合成されるPGEはPGE2であり、ジホモ-γ-リノレン酸やエイコサペンタエン酸からそれぞれPGE1及びPGE3が合成される。不飽和脂肪酸とPGEの構造をFig.2に示す。

Fig. 2 PGの合成に使用される不飽和脂肪酸 PGはジホモ-γ-リノレン酸やエイコサペンタエン酸から合成される
PGの役割は多様であり、多くの研究によりその機能が明らかになっている。合成されるPGおよびトロンボキサン(TX)の主な生理作用はFig. 3に示す。例えば、PGE2には血管拡張、発熱・疼痛、気管支拡張、胃液分泌作用、子宮筋収縮など作用があり、PGE2と類似した作用を示すPGE1(アルプロスタジル)は末梢血管拡張や動脈管依存性先天性心疾患における動脈管の開存のために医薬品として使用されている。PGI2にはPGE1と同様の作用が確認されており、PGI2誘導体ベラプロストは慢性動脈閉塞症(肺動脈性高血圧症)の治療に用いられている。また、PGF2α誘導体ラタノプロストやトラボプロストは緑内障の進展阻止や眼圧維持に用いられている。PGE2は生体内では主に炎症に応答して組織で盛んに産生されるため炎症を媒介すると理解されてきたが、これらのPG製剤の全身投与では一般に炎症は悪化しない。また、投与量や臓器・細胞の感受性などにより内因性の作用とは全く異なる反応を呈することが特徴である(1)。

Fig. 3 PG及びロイコトリエンの生理活性 LOX(リポオキシゲナーゼ)経路は主に白血球細胞で活性化されLTC4/D4やLTB2が生理活性を有する
3)PG受容体
シクロオキシゲナーゼから産生されるプロスタノイド(PGI、PGD、PGE、PGF、TX)にはそれぞれ細胞膜表面に発現する受容体としてIP、DP、EP、FP及びTPが同定されている(2)。これらの膜タンパク質受容体は細胞膜をα-ヘリックスが7回貫通する構造を特徴とし細胞内のG-タンパク質を活性化することで細胞応答を引き起こすGタンパク質共役受容体(GPCR)に分類される。EP受容体はEP1、EP2、EP3、EP4の4種の受容体から構成される。また、1999年に白血球に遊走を引き起こすケモアトラクタント(走化性因子)受容体として発見されたchemoattractant receptor-homologous molecule on Th2 cells(CRTH2)はPGD2の受容体として機能することが報告され(3,4)、現在ではDPにはDP1及びDP2の2つのサブタイプが分類されている。全9種の受容体に対する特異的なアゴニスト及びアンタゴニストに関する情報は総説(5,6)やGuide to PHARMACOLOGY webpageで閲覧可能である(7)
4)PG代謝とその代謝物
血液中に放出されたあるいは存在する、PGH2から直接合成される5つのPGの半減期(t1/2)は長いもので数秒から数分程度である(8)。In vivoにおけるこれらPGの半減期は放射性同位体を静脈内投与して評価されてきた。PGE2、PGD2、PGF2αは体内に広く分布する15-PGDHにより15位の水酸基が酸化を受けて速やかに不活性化される。これらの3つのPGのt1/2は約数分程度とされる (9)。一方、PGI2及びTXA2は異なる代謝経路により消失し、そのt1/2は数秒程度であり極めて短い (10)。また、PGI2及びTXA2は非常に不安定な構造のため、非酵素的に生物学的に活性を持たない6-keto PGF1α及びTXB2へと代謝されるため、PGI2及びTXA2の挙動はそれぞれ6-keto PGF1α及びTXB2を定量することにより同定することができる。PGの代謝経路をFig. 4に示す。

Fig. 4 PGの代謝経路 黄色は主に尿中、水色は主に血中、緑色はいずれにも存在する代謝物を示す。引用文献(8)を参考に作成した。1. Cyclooxygenase-1/2 (COX, EC 1.14.99.1); 2. Prostacyclin synthase (PTGIS, EC 5.3.99.4); 3. Thromboxane A synthase (TBXAS1, EC 5.3.99.5); 4. Hematopoietic prostaglandin D synthase (HPGDS, EC 2.5.1.18); 5. Lipocalin-type prostaglandin D synthase (L-PGDS, EC 5.3.99.2); 6. Microsomal prostaglandin E synthase-1 (MPGES1, EC 5.3.99.3); 7. Microsomal prostaglandin E synthase-2 (MPGES2, EC 5.3.99.3); 8. Cytosolic prostaglandin E synthase (CPGES, EC 5.3.99.3); 9. Prostaglandin F synthase (PGFS; EC 1.1.1.188); 10. Non-enzymatic degradation; 11. Albumin-mediated degradation; 12. 11-Hydroxy thromboxane dehydrogenase (EC 1.2.1.3); 13. 15-Hydroxyprostaglandin dehydrogenase (15-PGDH, EC 1.1.1.141); 14. 15-oxo-prostaglandin D13-reductase (EC 1.3.1.48); 15. NADPH-dependent PGD2 11-ketoreductase (EC 1.1.1.188); 16. Enzymatic -oxidation; 17. Enzymatic ω-oxidation; 18. PGE2 9keto-reductase (EC 1.1.1.189)
PGE2、PGD2、PGF2αは、細胞内へ取り込まれ15-PGDHにより酸化的に不活化されるため、代謝には取込み輸送体が必要である。Ferreiraと Vane は放射性PGE2の静脈内投与後、肺を一度通過すると血液中のPGE2の90%以上が消失することを見出した(11)。以来、①血液中からPG(i.e., PGE1, PGE2, PGD2, and PGF2α)が肺組織へ濃縮的に取り込まれること(12-14)、②有機アニオン膜輸送体を阻害するインドシアニングリーンをPGと同時に静注すうるとPGの主要な代謝物(15-keto PG and 13,14-dihydro 15-keto PG)が肺組織で認められなくなる(減少する)ことから(15)、肺組織において血液中PG(PGE2, PGD2, and PGF2α)は膜輸送担体により効率よく抽出されため、肺はPGの代謝臓器と考えられている。
5)炎症とPGE2
炎症は火傷や擦傷など物理的な刺激、化学薬品との接触などの化学的な刺激、あるいは細菌やウイルス感染など生物学的な要因に応答し免疫機能が働くことにより起こる生体防御反応である。発赤(rubor/red flare)、熱感(calor/heat)、腫脹(tumor/swelling)、疼痛(dolar/pain)の4兆候がみられる。このほかに機能障害を加え、5兆候を炎症の定義とすることもある。炎症部位において、炎症刺激により障害された細胞に関連する物質に共通のパターン(damage-associated molecular pattern/DAMPs)や病原体に由来する物質に共通なパターン(pathogen-associated molecular pattern/PAMPs)が免疫細胞に発現するToll様受容体(Toll-like receptor)などのパターン認識受容体(Pattern recognition receptor)により認識されると、Nf-κBが活性化され、炎症のプロセスに必要なタンパク質が生成される。Nf-κB活性化により誘導されるCOX2の主な代謝物はPGE2であり、PGE2は末梢に存在するマスト細胞からのヒスタミンの分泌を誘発する(16,17)。PGE2及びヒスタミンは強力な血管拡張作用/血管透過性亢進作用を示し炎症部位へ血流がするために発赤と熱感が起きる。また、活性化された末梢サイトカインネットワークが活性化され分泌されるTNF-α and IL-1βの働きにより、白血球細胞が炎症部位へと遊走し血管内皮細胞に付着し、血管の透過性亢進により組織へ透過すると、腫脹が生じる。組織へと移行したマクロファージや好中球などの免疫細胞により病原体が貪食され、増殖期(肉芽形成期)へと移行する(Fig. 5)。

Fig. 5 (急性)炎症のイメージ 傷害や病原体感染により組織がダメージを受けると(①)、PAMSやDAMPSを認識したパターン認識受容体(PRR)を介したシグナルによって、血管拡張因子(PGE2やヒスタミン)やケモカインなどの免疫細胞遊走因子が放出される(②) 。結果的に炎症部位へ遊走した免疫細胞が血管内皮細胞へと付着し、血管の拡張に伴って組織へと移行し始める(③、④)。組織へ移行した貪食能を有する免疫細胞により組織修復の障害となる異物が除去されると、炎症は増殖期へと進む。
増殖期は受傷後1~2週間続き、線維芽細胞による膠原繊維(コラーゲン)が産生され、毛細血管が発達し、肉芽組織が形成される。表皮組織による創傷部が被覆されると、表皮細胞が分化し真皮が再生される。一方で、創傷部が完全に被覆されない場合は肉芽が形成され瘢痕が残る。コラーゲンの産生と分解が平衡に達し(安定期)、細胞が減少し修復過程が完了する。PGE2及びPGI2は血管拡張作用を持ち末梢組織への血流を維持するため血管圧や開存性の調節に働く(18,19)。同時に、血管新生を促進する血管内皮細胞増殖因子(VEGF)の発現を誘導するため(20-22)、創傷治癒の過程においてが必須であるため、創傷治癒においてもPGの役割が指摘されている。直接的な情報限られているが、PGE2は創傷治癒における重要な因子であり(23)、PGE2濃度と創傷治癒速度には正の相関が報告されている(24)
6)PGE2トランスポーター(膜輸送体)がPGE2作用に及ぼす影響
細胞膜を構成するリン脂質から切り出されるアラキドン酸から細胞内で合成されるPGE2は、細胞外へ遊離されたのち細胞膜表面に存在するEP受容体を介してシグナルを伝達する。産生されるPGE2のシグナル伝達調節はホメオスタシスや急性炎症プロセスに必須である。PGE2はNAD+依存性の15-PG脱水素酵素(15-PGDH)により15(S)位の水酸基が酸化され15-keto PGE2へと酸化された後、NADPH/NADH 依存性Δ13-15-ketoprostaglandin reductaseによりさらに代謝される(25)。15-keto PGE2にはPGE2活性はみられないため、15-PGDHはPGE2代謝には必須であり、PGE2のシグナルを終息させる因子として古くから知られてきた(26)。さらに、PGE2シグナルにおける15-PGDHの重要性は15-PGDHをコードするHPGD遺伝子の変異の潜性(劣性)遺伝により、PGE2代謝異常を原因とし、ばち指や脳回転状皮膚を主徴とする肥厚性皮膚骨膜症(PDP、または原発性肥大性骨間接症、PHO)が発症することからも実証された(27)。15-PGDHに関する研究は1970年頃から精力的に行われ、ヒト、イヌ、ネコなど多くの哺乳類動物において血液中や細胞外永久中における15-PGDHの活性が殆ど検出されないことが明らかになった(11,28)。PGE2の細胞への取込み過程が重要であることが示唆されていた。1990年代後半になり、アメリカの生化学者Victor L. SchusterらによりPGを細胞内へ取り込むトランスポーター(PGT、別名OATP2A1)をコードする遺伝子SLCO2A1がラット(29)やヒト(30)で同定されると、in vitro実験系において、①15-PGDHとSLCO2A1を共発現させた細胞でPGE2の代謝が速やかに起こること、②15-PGDHを発現させても、細胞膜を溶解させない限りPGE2が代謝されないことが示された(31,32)。この発見により、PGE2の(再)取込みがPGE2の代謝過程と1つのプロセスとして位置づけられ、取込みと代謝の2つのステップでPGE2のシグナルが失活することが提唱され、PGE2の取込み過程は代謝の律速段階と考えられている(Figure 4A)。その後、SLCO2A1以外にPG取込み寄与する有機アニオン膜輸送体が複数報告されたが(33)、血族結婚した中国漢民族家族を対象としエクソーム解析(ゲノムのエクソン領域のみを濃縮して行う遺伝子配列解析)により、SLCO2A1機能欠損型変異の潜性遺伝が肥厚性皮膚骨膜症を発症させることが初めて示され(34)、SLCO2A1がPGE2の代謝とシグナル調節に支配的な役割を果し、HPDGと協調してPGE2のシグナルを終息させることが明らかになった。興味深いことに、2015年には、九州大学の梅野らにより、SLCO2A1は非特異性多発性小腸潰瘍症の原因遺伝子としても同定された(35)。現在では大腸癌の進展との関りも報告されているが、PGE2の局所動態と病態との関係が解明されていない事象も多く、今後病態生理学的な意義の解明が期待される。病態との関連については当研究室からの総説を参考にされたい (36)。
7)引用文献
-
川井眞一. (2012) プロスタグランジン. Clin Rheumatol 24, 88-89
-
Coleman, R. A., Smith, W. L., and Narumiya, S. (1994) International Union of Pharmacology classification of prostanoid receptors: properties, distribution, and structure of the receptors and their subtypes. Pharmacol. Rev. 46, 205-229
-
Nagata, K., Tanaka, K., Ogawa, K., Kemmotsu, K., Imai, T., Yoshie, O., Abe, H., Tada, K., Nakamura, M., Sugamura, K., and Takano, S. (1999) Selective expression of a novel surface molecule by human Th2 cells in vivo. J Immunol 162, 1278-1286
-
Nagata, K., Hirai, H., Tanaka, K., Ogawa, K., Aso, T., Sugamura, K., Nakamura, M., and Takano, S. (1999) CRTH2, an orphan receptor of T-helper-2-cells, is expressed on basophils and eosinophils and responds to mast cell-derived factor(s). FEBS Lett 459, 195-199
-
Jones, R. L., Giembycz, M. A., and Woodward, D. F. (2009) Prostanoid receptor antagonists: development strategies and therapeutic applications. Br J Pharmacol 158, 104-145
-
Biringer, R. G. (2021) A Review of Prostanoid Receptors: Expression, Characterization, Regulation, and Mechanism of Action. J Cell Commun Signal 15, 155-184
-
Prostanoid receptors. in The IUPHAR/BPS Guide to PHARMACOLOGY (Davies, J. ed., the Centre for Discovery Brain Sciences, the University of Edinburgh, https://www.guidetopharmacology.org/GRAC/FamilyDisplayForward?familyId=58
-
Idborg, H., and Pawelzik, S. C. (2022) Prostanoid Metabolites as Biomarkers in Human Disease. Metabolites 12, 721
-
Hamberg, M., and Samuelsson, B. (1971) On the metabolism of prostaglandins E 1 and E 2 in man. J Biol Chem 246, 6713-6721
-
Needleman, P., Moncada, S., Bunting, S., Vane, J. R., Hamberg, M., and Samuelsson, B. (1976) Identification of an enzyme in platelet microsomes which generates thromboxane A2 from prostaglandin endoperoxides. Nature 261, 558-560
-
Ferreira, S. H., and Vane, J. R. (1967) Prostaglandins: Their Disappearance from and Release into the Circulation. Nature 216, 868-873
-
Robinson, C., and Hoult, J. R. (1982) Inactivation of prostaglandins in the perfused rat lung. Biochem Pharmacol 31, 633-638
-
Linehan, J. H., and Dawson, C. A. (1979) A kinetic model of prostaglandin metabolism in the lung. J Appl Physiol Respir Environ Exerc Physiol 47, 404-411
-
Piper, P., Vane, J., and Wylllie, J. (1970) Inactivation of prostaglandins by the lungs. Nature 225, 600-604
-
Pitt, B. R., Forder, J. R., and Gillis, C. N. (1983) Drug-induced impairment of pulmonary [3H]prostaglandin E1 removal in vivo. J Pharmacol Exp Ther 227, 531-537
-
Kawahara, K., Hohjoh, H., Inazumi, T., Tsuchiya, S., and Sugimoto, Y. (2015) Prostaglandin E2-induced inflammation: Relevance of prostaglandin E receptors. Biochim Biophys Acta 1851, 414-421
-
Morimoto, K., Shirata, N., Taketomi, Y., Tsuchiya, S., Segi-Nishida, E., Inazumi, T., Kabashima, K., Tanaka, S., Murakami, M., Narumiya, S., and Sugimoto, Y. (2014) Prostaglandin E2-EP3 signaling induces inflammatory swelling by mast cell activation. J Immunol 192, 1130-1137
-
Weeks, J. R. (1972) Prostaglandins. Annu Rev Pharmacol 12, 317-336
-
Neisius, U., Olsson, R., Rukwied, R., Lischetzki, G., and Schmelz, M. (2002) Prostaglandin E2 induces vasodilation and pruritus, but no protein extravasation in atopic dermatitis and controls. J Am Acad Dermatol 47, 28-32
-
Hatazawa, R., Tanaka, A., Tanigami, M., Amagase, K., Kato, S., Ashida, Y., and Takeuchi, K. (2007) Cyclooxygenase-2/prostaglandin E2 accelerates the healing of gastric ulcers via EP4 receptors. Am J Physiol Gastrointest Liver Physiol 293, G788-G797
-
Spinella, F., Rosano, L., Di Castro, V., Natali, P. G., and Bagnato, A. (2004) Endothelin-1-induced prostaglandin E2-EP2, EP4 signaling regulates vascular endothelial growth factor production and ovarian carcinoma cell invasion. J Biol Chem 279, 46700-46705
-
Ben-Av, P., Crofford, L. J., Wilder, R. L., and Hla, T. (1995) Induction of vascular endothelial growth factor expression in synovial fibroblasts by prostaglandin E and interleukin-1: a potential mechanism for inflammatory angiogenesis. FEBS Lett 372, 83-87
-
Kampfer, H., Brautigam, L., Geisslinger, G., Pfeilschifter, J., and Frank, S. (2003) Cyclooxygenase-1-coupled prostaglandin biosynthesis constitutes an essential prerequisite for skin repair. J Invest Dermatol 120, 880-890
-
Kampfer, H., Schmidt, R., Geisslinger, G., Pfeilschifter, J., and Frank, S. (2005) Wound inflammation in diabetic ob/ob mice: functional coupling of prostaglandin biosynthesis to cyclooxygenase-1 activity in diabetes-impaired wound healing. Diabetes 54, 1543-1551
-
Tai, H. H., Ensor, C. M., Tong, M., Zhou, H., and Yan, F. (2002) Prostaglandin catabolizing enzymes. Prostaglandins Other Lipid Mediat 68-69, 483-493
-
Anggard, E. (1966) The biological activities of three metabolites of prostaglandin E 1. Acta Physiol Scand 66, 509-510
-
Uppal, S., Diggle, C. P., Carr, I. M., Fishwick, C. W., Ahmed, M., Ibrahim, G. H., Helliwell, P. S., Latos-Bielenska, A., Phillips, S. E., Markham, A. F., Bennett, C. P., and Bonthron, D. T. (2008) Mutations in 15-hydroxyprostaglandin dehydrogenase cause primary hypertrophic osteoarthropathy. Nat. Genet. 40, 789-793
-
Holmes, S. W., Horton, E. W., and Stewart, M. J. (1968) Observations on the extraction of prostaglandins from blood. Life Sci 7, 349-354
-
Kanai, N., Lu, R., Satriano, J. A., Bao, Y., Wolkoff, A. W., and Schuster, V. L. (1995) Identification and characterization of a prostaglandin transporter. Science 268, 866-869
-
Lu, R., Kanai, N., Bao, Y., and Schuster, V. L. (1996) Cloning, in vitro expression, and tissue distribution of a human prostaglandin transporter cDNA(hPGT). J. Clin. Invest. 98, 1142-1149
-
Nomura, T., Lu, R., Pucci, M. L., and Schuster, V. L. (2004) The two-step model of prostaglandin signal termination: In vitro reconstitution with the prostaglandin transporter and prostaglandin 15 dehydrogenase. Molecular pharmacology 65, 973-978
-
Nomura, T., Chang, H. Y., Lu, R., Hankin, J., Murphy, R. C., and Schuster, V. L. (2005) Prostaglandin signaling in the renal collecting duct: release, reuptake, and oxidation in the same cell. The Journal of biological chemistry 280, 28424-28429
-
Tamai, I., Nezu, J.-i., Uchino, H., Sai, Y., Oku, A., Shimane, M., and Tsuji, A. (2000) Molecular identification and characterization of novel members of the human organic anion transporter (OATP) family. Biochem Biophys Res Commun 273, 251-260
-
Zhang, Z., Xia, W., He, J., Ke, Y., Yue, H., Wang, C., Zhang, H., Gu, J., Hu, W., Fu, W., Hu, Y., Li, M., and Liu, Y. (2012) Exome sequencing identifies SLCO2A1 mutations as a cause of primary hypertrophic osteoarthropathy. Am. J. Hum. Genet. 90, 125-132
-
Umeno, J., Hisamatsu, T., Esaki, M., Hirano, A., Kubokura, N., Asano, K., Kochi, S., Yanai, S., Fuyuno, Y., Shimamura, K., Hosoe, N., Ogata, H., Watanabe, T., Aoyagi, K., Ooi, H., Watanabe, K., Yasukawa, S., Hirai, F., Matsui, T., Iida, M., Yao, T., Hibi, T., Kosaki, K., Kanai, T., Kitazono, T., and Matsumoto, T. (2015) A Hereditary Enteropathy Caused by Mutations in the SLCO2A1 Gene, Encoding a Prostaglandin Transporter. PLoS Genet. 11, e1005581
-
Nakanishi, T., Nakamura, Y., and Umeno, J. (2021) Recent advances in studies of SLCO2A1 as a key regulator of the delivery of prostaglandins to their sites of action. Pharmacol Ther 223, 107803
2.これまでに行ってきた研究
1)肺上皮細胞におけるPG膜輸送体SLCO2A1 (PGT) の機能解析
肺は最もPGE2産生能が高い組織の1つである。PGE2はCOXを経てアラキドン酸から生じるPGH2からPGESを経て合成される。PGESには3種類のアイソフォーム、すなわち細胞質に存在するcPGESおよびミクロソーム膜結合形のmPGES1、mPGES2が存在し、炎症や癌などの病態で誘導されるCOX2/mPGES1経路でPGE2が盛んに合成されるため、mPGES1は抗炎症作用の標的分子として捉えられている(1)。一方、PGE2は様々な組織において抗炎症作用を示すことが知られている。生理的な条件下において、気管支上皮のPGE2濃度は血漿中濃度よりも高く(2)、気道上皮の迅速な修復に重要な役割を果す(3)。さらに免疫細胞の活性化を抑制し、好炎症性サイトカイン産生やヒスタミン、ロイコトリエンの産生を制限することにより喘息を予防する効果が認められている(4)。おそらくPGE2はTh2の分化を抑制するために、IgEの産生を阻害すると考えられている(5)。さらに、PGE2は肺上皮が障害されると、上皮細胞と線維芽細胞増殖を調節し、組織を正常に修復させる役割を果す。PGE2はIL-8、IL-12、MCP-1やGM-CSFなどの好炎症性サイトカインの産生を抑制し、繊維芽細胞の増殖や筋線維芽細胞への分化を抑えることで喘息や線維化等の病態における組織リモデリングに強くかかわる。
(1) 肺上皮細胞におけるPG膜輸送体SLCO2A1 の発現
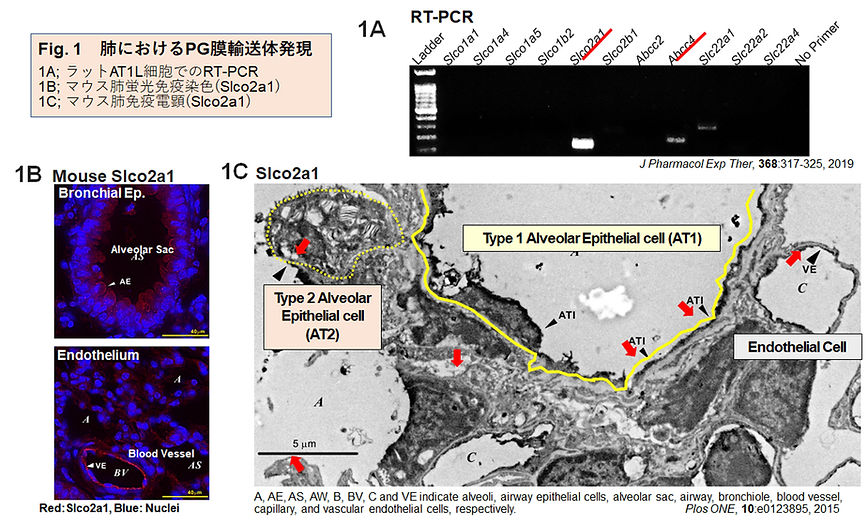
このような背景から、下気道および肺呼吸領域におけるPG動態を明らかにするために、私たちのグループは気道及び肺胞上皮細胞におけるプロスタグランジン膜輸送体の発現と機能を解析してきた。初代培養ラット2型肺胞上皮細胞(AT2)を1型肺胞上皮細胞(AT1)へ分化転換させたAT1様細胞(AT1L)において、PGを基質とする膜輸送体の発現をRT-PCRにより検討した(Fig.1A)。Slco2a1の発現が最も高く、PGE2を細胞外へと排出するMRP4(Abcc4)の発現も認められた(6)。また、マウス肺免疫組織化学により下気道上皮およびAT1肺胞腔側膜、血管内皮細胞に強い抗原抗体反応を認め(Fig. 1B & C)、RNAの高発現は肺組織における高いSLCO2A1タンパク質発現と一致した(7)。ラットから調製したAT2初代培養細胞ではSlco2a1のタンパク質発現は細胞膜に認められず、4日以降培養したAT1Lで細胞膜に局在する強い抗原抗体反応が確認された(Fig. 2A)。さらに、SLCO2A1タンパク質のPG輸送機能を確認するため、野生型(Wt)及びSlco2a1全身KOマウスからそれぞれ調製したAT1L細胞において[3H]PGE2取込みを比較した結果、Slco2a1-KO AT1LではWtで観察された取込み活性の約8割が消失した(Fig. 2B)。しがって、SLCO2A1は肺胞上皮細胞に発現し、肺胞腔からPGを細胞へ取り込む膜輸送体として機能することが示された。

(2) 肺線維化モデルにおけるSLCO2A1 の発現
SLCO2A1によるPG濃度調節が組織リモデリングに及ぼす影響を明らかにするためにWtおよびSlco2a1 KOの気管内にブレオマイシン(BLM)を投与し線維化肺を作製した。生理食塩水を投与群では、Slco2a1欠損による肺組織の構造変化は認められなかった(Fig. 3A)。BLM投与2週間後、Slco2a1 KOマウス肺のHE染色像ではWtよりも広範囲に及ぶ肺胞壁の肥厚および肺胞領域の崩壊が観察され、膠原(コラーゲン)線維の蓄積を示す強いシリウスレッド染色(赤色)が観察された(7)。さらに、組織の線維化と強く関連するTgf-β1やそのシグナルの下流に位置するメディエータ分子であるα-SmaやPai-1などをコードする遺伝子のmRNA発現が有意に高値を示したことから(Fig. 3B)、Slco2a1の欠損によりBLMに誘導される組織のリモデリング(線維化)が進行したと考えられた。次に、PGE2動態については肺組織及び気管支肺胞洗浄液(BALF)中のPGE2濃度を測定した。Fig. 4Aに示すように、BLM投与後の肺組織中のPGE2濃度はKOマウスで低下する傾向がみられた。PBS投与群ではBALF中のPGE2量にはWtおよびKOマウスで有意な差は観察されなかったが、BLM投与2週間後では、PGE2量はKOで顕著に増加した。さらに、48種類のエイコサノイドを標的としたメタボロミクス解析を行った結果、BLF中に検出されたエイコサノイドは7種類しかなく、KOマウスで顕著に増加したものはPGE2のみであった(7)。


(3) 肺線維化モデルにおけるSLCO2A1 の発現
SLCO2A1がPGE2の蓄積のみならずその膜透過に関わるか否かを検討するために、ラットAT1Lを用いPGE2の膜透過を評価した(6)。AT1Lをトランスウェルに培養後、アピカル(AP、肺胞腔)側からバソラテラル(BL、組織)側への[3H]PGE2の膜透過は時間に比例して増加し、BSP存在下では有意に低下した(Fig. 5A)。PGE2の膜透過係数(Pc)は細胞間隙マーカーであるマンニトールの約20倍以上の高値を示し、その値はBSP存在下で約1/4以下に低下した。興味深いことに、BL側からAP側への膜透過はAP側からBL側への膜透過の約1/4程度で、BSPによる阻害効果もみられなかった (Fig. 5B)。PGE2の膜透過に濃度依存性があり、Michaels-Menten式によるフィッティングからKm値は118 nMと見積もられ、PGE2の取込みのKm値とほぼ同程度の値を示した(Fig. 5C)。Fig. 1AからラットAT1LにはPGE2の排出に働くと考えられるMrp4発現が示唆されてたため、MRP4の選択的阻害剤Ceefourin 1の効果を評価した(Fig. 5D)。AP側からBL側へのPGE2の透過速度はCeefourin 1存在下で部分的であるが、有意に阻害された。以上の観察結果から、SLCO2A1を介したPGE2の膜透過は肺胞腔から組織方向へ選択的に行われことが示され、細胞から排出にはMRP4の寄与が示唆された。

(4) まとめ
SLCO2A1は肺胞や気道内からのPGE2取込み支配的な�役割を果することが示された。したがって、その機能や発現の低下は、気道または肺胞腔でPGE2のうっ滞を招き、PGE2の過剰なシグナル入力によりポジティブフィードバックがかかり、COX2によるPGE2産生が亢進し肺胞腔へ浸潤した炎症細胞を刺激するため、炎症の慢性化に貢献することが初めて明らかなった。つまり、これらの結果はPG膜輸送体が肺・呼吸領域の毒性の作用点として重要であることを示し、大気中の生体異物(タバコ煙など)や薬物との相互作用が肺毒性の新たなメカニズムして検証されることが期待される。
2.これまでに行ってきた研究
2)中枢神経系におけるSLCO2A1の役割
一方、PGは脳の機能と密接関わります。世界保健機関WHOによれば、世界のうつ病患者は3億人前後、認知障患者は5000 万人程度と推計されています。近年、うつ病およびアルツハイマー病などの中枢神経系疾患の患者数は増加の一途を辿り、未曽有の高齢化社会を迎える今後はさらに増加すると予想されています。したがって、これらの精神疾患の予防や治療法を確立することは喫緊の課題と言えます。近年、中枢や循環血中のPG濃度が中枢神経系疾患患者で変動していることが分かってきました。ところが、中枢のPG濃度が調節される仕組みや、中枢神経系疾患におけるPGの役割は十分に解明されていません。私たちはこれまでに、SLCO2A1が脳内のミクログリアや血管内皮細胞に発現し、体温調節を担う視床下部におけるPGE2量の調節に関わることを発見しました(J Neurosci, 2018)。結果的に、SLCO2A1ノックアウトマウスでは、炎症性の発熱が抑制されることを報告しています。現在、SLCO2A1が脳内のPGE2の作用を調節するkey regulatorであると位置づけ、SLCO2A1以外のPG膜輸送体も含め、中枢のPG調節機構を明らかにすべく研究を展開しています(図2)。

